Cell Stem Cell专家点评丨刘光慧/汤富酬/曲静合作组通过基因编辑获得优质人类血管细胞
Cell Stem Cell专家点评丨刘光慧/汤富酬/曲静合作组通过基因编辑获得优质人类血管细胞
点评丨兰雨(暨南大学)
责编丨迦溆
干细胞技术在再生医学中具有广阔的应用前景。由干细胞体外诱导分化获得的多种类型细胞移植入病灶部位后,可达到促进病损组织再生、恢复组织器官稳态和功能的目的。然而,干细胞治疗在有效性和安全性方面尚存局限,阻碍了该技术的普及。
来自中国科学院生物物理研究所刘光慧研究组、北京大学汤富酬研究组和中国科学院动物研究所曲静研究组联合攻关,于2019年1月17日在Cell Stem Cell上发表了题为FOXO3-engineered human ESC-derived vascular cells promote vascular protection and regeneration的重要研究成果,通过靶向编辑单个长寿基因产生了世界上首例遗传增强的人类血管细胞。这些血管细胞与野生型血管细胞相比,不但能更高效地促进血管修复与再生,而且能有效抵抗细胞的致瘤性转化。遗传增强人类血管细胞的成功获得为开展安全有效的临床细胞治疗提供了重要解决途径。

FOXO3(Forkhead box O3 )是重要的人类长寿基因,与延缓细胞衰老、抵御外界应激和增强心血管稳态关系密切【1】。此外,FOXO3的活化可通过诱导抑癌基因表达抵抗细胞的恶性转化。研究人员历时六年的探索,最终利用第三代腺病毒载体HDAdV(helper-dependent adenovirus vector,辅助病毒依赖型腺病毒载体)介导的基因编辑技术巧妙地置换了人类胚胎干细胞中FOXO3基因的第3号外显子中的两个单核苷酸,从而实现了抑制细胞中FOXO3蛋白的磷酸化和降解,促进FOXO3在细胞核内的聚集进而激活下游靶基因的表达。
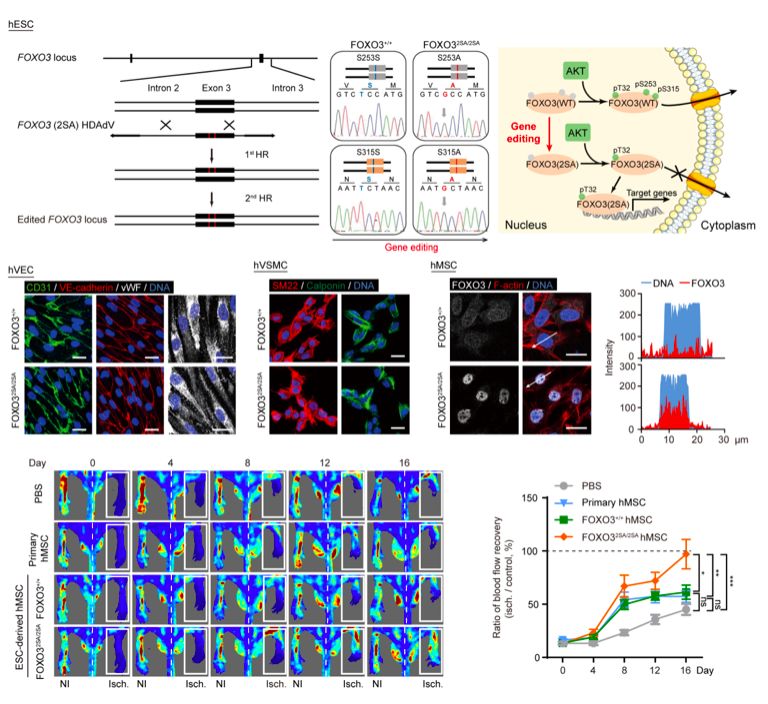
图1. 通过基因编辑产生FOXO3功能增强的人类血管细胞,用于治疗缺血性血管病变
当FOXO3遗传增强的人类胚胎干细胞被定向分化为血管内皮细胞(血管内膜)、血管平滑肌细胞(血管中膜)及间质细胞(血管外膜)时,这三种血管细胞均表现出比野生型细胞更强的自我更新、抵抗氧化损伤及延缓细胞衰老等能力。在机制方面,内源激活的FOXO3通过拮抗CSRP1(Cysteine- and glycine-rich protein 1)基因【2】表达介导对血管细胞衰老的抵抗作用。更为重要的是,将遗传增强的人类血管细胞靶向移植到动物模型的缺血部位,可高效促进受损血管的再生,迅速恢复缺血部位的血流,证明这些细胞具有明显优于野生型细胞的血管修复能力。
为验证遗传增强干细胞作为移植材料的安全性,研究人员将多种致癌基因导入野生型和遗传增强的干细胞中,发现遗传增强干细胞还可以有效地抵抗癌基因诱导的细胞恶性转化。综上所述,通过改写人类基因组中的两个碱基,研究团队成功建立了可同时抵抗细胞衰老和癌变的优质人类血管细胞。
图2. FOXO3增强型人血管细胞对细胞癌化具有强抵抗作用
该项研究首次利用基因编辑技术实现了人类血管细胞的功能增强,揭示了长寿蛋白FOXO3维持人类血管稳态的新机制,从概念上证明了利用基因编辑策略获得优质安全人类血管细胞移植物的可行性。此外,该研究使规模化和标准化制备优质安全的人类细胞治疗材料成为可能,为未来的再生医学提供了一个具有潜力的选项,对发展更加安全有效的临床细胞治疗策略具有深远意义。

图3. FOXO3功能增强可延缓血管衰老,增强应激抵抗并防止细胞癌变
刘光慧团队长期致力于通过基因编辑实现人类遗传突变靶向矫正及人类细胞遗传增强的研究,并取得了一系列开拓性的研究成果。包括:利用辅助病毒依赖的腺病毒载体(HDAdV)介导的基因编辑首次实现了人类干细胞中致病基因突变的高效矫正(Cell Stem Cell2011);首次证明了HDAdV和TALEN两种基因编辑工具的安全性,发展了安全高效的新型基因编辑工具telHDAdV(Cell Stem Cell2014);在人类(疾病)干细胞中修复或编辑了10余种致病基因突变,并基于此建立了相关疾病研究和药物筛选平台(Cell2016,Science2015,Nature2012,Nature2011,Nat Commun2014,Cell Stem Cell2011,Cell Res2016;Protein Cell2016,Aging Cell2017);在经典基因编辑工具TALEN基础上研发三维基因组动态成像工具TTALE(Cell Res2017);利用CRISPR/Cas9建立了世界上首例长寿基因敲除猴模型(Nature2018)。
本次遗传增强人类血管细胞的获得,是继刘光慧团队创建国际首例抵抗细胞衰老和癌变的遗传增强人类干细胞(Cell Res2017)(遗传增强:刘光慧等利用基因编辑获得“超级”干细胞【附专家点评】)之后,人类细胞功能增强策略应用于再生医学研究领域的又一次重大突破。这些研究成果均表明,人类基因组的遗传密码可以被创造性改写,并有望被安全有效地应用于疾病治疗。
据悉,该研究工作由中科院生物物理所、中科院动物所、中科院干细胞与再生创新研究院、北京大学、首都医科大学宣武医院等机构合作完成。中科院生物物理所刘光慧研究员、北京大学汤富酬研究员以及中科院动物所曲静研究员为共同通讯作者。中科院生物物理所硕士研究生颜鹏泽和北京大学博士研究生李晴晴为并列第一作者。
原文链接:https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(18)30592-7
参考文献:
1、Martins, R., Lithgow, G.J., and Link, W. (2016). Long live FOXO: unraveling the role of FOXO proteins in aging and longevity. Aging Cell 15, 196–207.
2、Pomie` s, P., Louis, H.A., and Beckerle, M.C. (1997). CRP1, a LIM domain protein implicated in muscle differentiation, interacts with alpha-actinin.J. Cell Biol. 139, 157–168
专家点评
兰雨(暨南大学基础医学院研究员)
当今中国正逐步进入老龄化社会,人口老龄化将直接导致衰老相关疾病的高发,这将给我国医疗卫生事业带来极大的挑战。将前沿生物技术成果尽快用于机体衰老防治的研究已经成为当今生命科学领域的热点和前沿。刘光慧/汤富酬/曲静研究组合作发表在Cell Stem Cell上的论文,以靶向血管保护和抗衰老为目标,通过对胚胎干细胞中FOXO3基因的两个核苷酸位点进行基因修饰使其持续活化,发现从而分化而来的血管细胞具有保护血管以及促进血管再生的功能。这是该研究组继在间充质干细胞中对NRF2基因进行单个核苷酸编辑改造使持续活化从而使细胞具有抵抗氧化应激以及促进血管再生作用的研究成果后【1】,在血管再生策略研究领域的又一个重要发现。
作者选择FOXO3这个与长寿相关的进化保守的转录因子作为对象,通过在胚胎干细胞中对其两个经典磷酸化位点(Ser253和Ser315)的基因修饰,使其定位在细胞核中并持续活化。接下来,作者关注了由基因修饰的胚胎干细胞分化而来的三种跟血管结构密切相关的细胞类型(血管内皮细胞、血管平滑肌细胞、间充质干细胞),发现FOXO3持续活化使细胞增殖增加、可抵抗氧化应激诱导的细胞凋亡、延缓细胞衰老。特别是体内功能研究显示,FOXO3持续活化的血管内皮和平滑肌细胞或者间充质干细胞的局部注射均可使得下肢缺血模型小鼠的血管新生及血流再灌注明显改善。进一步机制研究发现FOXO3的活化通过招募SIRT1而抑制了CSRP1的转录和表达,从而介导了FOXO3的血管保护作用。最后,研究显示FOXO3持续活化的间充质干细胞可抵抗癌基因诱导的肿瘤转化。
上述研究揭示了FOXO3介导血管保护的机制,对于未来血管再生领域开发安全有效的细胞生物材料提供了重要的理论依据。在这个重要的工作基础上,进一步了解FOXO3-CSRP1分子轴对于不同类型细胞的抗衰老作用是否具有普适价值则是将来可能的研究方向。此外,血管再生的一个重要命题是动脉化的机制研究【2】,该分子轴是否在血管新生后的动脉化过程中发挥作用值得进一步关注。最后,作者建立的小鼠下肢缺血模型中将间充质干细胞通过局部注射体内可转化为血管内皮细胞的发现,也为干细胞命运可塑性的研究提供了有意思的线索。
制版人:子阳
参考文献
1. Yang J, et al.,Genetic enhancement in cultured human adult stem cells conferred by a singlenucleotiderecoding. Cell Res.2017 Sep;27(9):1178-1181.
2. Simons M,Eichmann A. Molecular controls of arterial morphogenesis. Simons M, Circ Res.2015 May 8;116(10):1712-24.